Die Haut ist ein stratifiziertes Gewebe, dessen äußerste Schicht das Stratum Corneum ist. Sie wird auch Hornschicht genannt. Lange galt diese als „tot“ bis überflüssig und war nicht im Fokus wissenschaftlicher Untersuchungen. Die Funktionen der Haut verstehen wir heute besser. Von einem umfänglichen Verständnis wage ich aber nicht zu sprechen. Denn die Sichtweise auf die Haut und vor allem ihrer Barrierefunktion hat sich in den letzten Jahrzehnten gravierend gewandelt.
Die Haut – eine effektive Barriere gegen das Außen
Machen wir uns nichts vor: Wir beschäftigen uns erst mit der Haut (oder anderen Körperteilen), wenn etwas nicht stimmt. Dann wollen wir wissen, wieso. Und die meisten wollen nur einfach eine schnelle Lösung. Wenn es aber um das Verständnis des Aufbaus der Haut und ihren verschiedenen Stoffwechselvorgängen darin geht, ist „schnell“ eine schlechte Herangehensweise. Denn die Qualität unserer Ergebnisse hängt ab von den Methoden, die wir zur Untersuchung verwenden.
Dass die Haut, eines der „banalsten“ Organe des Körpers, überhaupt untersucht wurde, lag weniger an der Idee der Grundlagenforschung als dem Drang, etwas in oder über die Haut in den Körper zu bekommen. Kurz, es stellte sich heraus, dass die Haut einer der best gesicherten Zugänge zum Körper ist.
Und das ist auch logisch, denn die Haut bildet DIE Barriere gegen alle äußeren terrestischen Einflüsse wie Luftfeuchtigkeit, UV-Strahlung, mechanische Reize, Angriffe von Mikroorganismen oder Kosmetik.
Was dabei lange unterschätzt wurde ist die Rolle der Hornschicht, des Stratum Corneums. Eine Schicht der Epidermis, die aus gerade mal 18-20 Zelllagen besteht (1) und eine Dicke von 10-30mm hat.
Also echt wenig im Vergleich zu der Größe unseres Körpers.
Stratum Corneum – tot oder lebendig?
Albert Kligman, einer der Begründer der Korneotherapie, fragte in seinem posthum veröffentlichten Artikel, wie das tote Stratum Corneum lebendig wurde (2).
Ronald Marks beschäftigte sich als emeritierter Professor 2014 mit einem Rückblick auf das Stratum Corneum bzw wie seine Bedeutung in der Wissenschaft erst erkannt wurde. Denn vor 50 Jahren galt es als “pink wispy stuff”, der bei mikroskopischen Untersuchungen zu sehen war. „Nothing to be bothered with“ war die Einstellung der späten 60iger und frühen 70ger Jahre dazu (3).
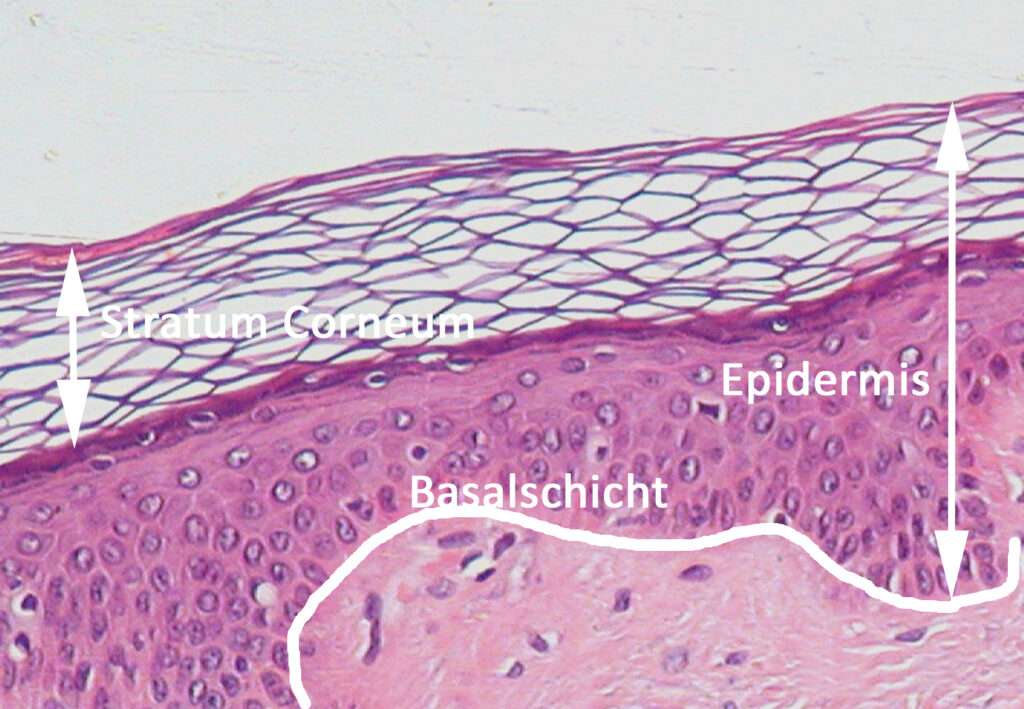
Das lag an den damalig verwendeten mikroskopischen Methoden, bei denen die Haut immobilisiert und getrocknet wurde. Dabei löste sich das Stratum Corneum vom Rest der Haut und sah nach einer „Korbflecht-Struktur“ aus (basket weave structure).
Als 2006 das Buch „Skin Barrier“ (4) veröffentlicht wurde, standen knapp 40 Jahre Forschung dahinter, die die Sicht auf die Hautbarriere komplett verändert haben. Dabei sind auch durch die Betrachtung von krankhaften Hautveränderungen wie Atopischer Dermatitis oder Psoriasis große Fortschritte erzielt worden, sowie bei genetischen Hautveränderungen.
Dabei hat die moderne Sichtweise auf die Haut viele Väter und zunehmend mehr Mütter.
| Wer | Wann | Was |
| Homolle, Durieu | 1850-60 | Die Haut ist eine Barriere, sie ist in Schichten aufgebaut |
| Rein | 1920-30 | Definition der Eigenschaften der Hautbarriere |
| Windsor & Burch | 1940-50 | Das Stratum Corneum läßt sich mittels Tape-stripping entfernen |
| Blank | 1953 | Barrierefunktion der Haut ist im Stratum Corneum lokalisiert |
| Berenson & Burch Onken & Moyer | 1950-60 | Die Permeabilität des Hornschicht ist abhängig von ihrem Lipid-Gehalt |
| Kligman & Christophers | 1964 | Untersuchungen der Haut mittels optischer Mikroskopie, Beschreibung des Stratum Corneums als „basket weaved structure“ |
| Brecky | 1966 | Die Lipide der Haut befinden sich im interzellulären Raum des Stratum Corneums |
| Scheuplein & Blank | 1971 | Stratum Corneum wirkt als Permeabilitätsbarriere |
| Elias & Friend Michaels | 04/1975 09/1975 | Beschreibung des Stratum Corneums mittels „Brick and Mortar“ – Model |
| Elias, Wertz, Schwartzendruber, Downing | 1977-1987 | Zusammensetzung der Stratum Corneum Lipide aus Cer:Chol:FFA = 1:1:1 Untersuchung des Übergangs Stratum granulsoum – Stratum Corneum mittels Gefrierbruch EM |
| Menon, Elias, Flynn, Pfeiffer et al, Norlén | 1989-2000 | Untersuchungen der Doppelschicht-Struktur der Stratum Corneum Lipide Mittels TEM |
| Madison, Heu | 1987-1991 | Untersuchung der Lamellar Bodies mittels Gefrierbruch TEM |
| Bowstra et al. | Ab 1990 | Strukturuntersuchungen der Lipid-Doppelschichten des Stratum Corneums mittels Synchotron –X-ray diffraction |
| Simon, Bernard , Caubert | Um 2000 | Desmosome halten die Corneozyten zusammen, nicht die Lipide |
| Verschiedene Arbeitsgruppen | Ab 1990 | Biochemisches Geschehen in der Epidermis besonders Umwandlung der Barrierelipid-Vorläufet |
| Uchida, Crumrine et al | 2000 | Corneocyte Lipide Envelope |
| Bowstra et al | Ab 1998 | Rolle des Ceramid -1 Acyl CER EOS in der Ausbildung des interzellularen Lipiddoppelschichten |
| Norlén et al | Ab 2018 | Cryo EM und mathematische Modellierungen beschreiben die Ultrastruktur der Stratum Corneum Lipide und den Mechanismus der Umwandlung der Glucosylceramide in den Lamellar Bodies |
Eine Frage des Blickwinkels – die Entdeckung der Lipidbarriere
An der Forschung zur Hautbarriere läßt sich sehr gut nachvollziehen, wie die sich verändernden Untersuchungsmethoden den Blick auf die Haut gewandelt haben.
Während bei der optischen Mikroskopie die Haut fixiert und gefärbt und dann das Stratum Corneum als loses Gewebe sichtbar wurde (Abb 1) – und ignoriert, weiß man heute, dass dieses Aussehen ein Artefakt ist. Es wurde durch die Präparation der Probe verursacht. Ähnlich war es auch bei der Elektronenmikroskopie, bei der ebenfalls Proben fixiert d.h. getrocknet wurden, was zum Aufbrechen der zellulären Strukturen führte. Dennoch wurden durch sogenannte „Färbungen“ mit RuO4 die Lipide sichtbar. Daraus wurde das Modell des Stratum Corneums als aus Ziegelsteinen und Mörtel bestehend entwickelt. Erst mit den neueren Analyseverfahren, nämlich der Cryo-Elektronenmikroskopie (bei denen zelluläre Strukturen erhalten bleiben) und mathematischen Simulationen gelingt es, die Dynamik der Entstehung der Lipidbarriere nachzuvollziehen (7).
Ein Meilenstein in der Stratum Corneum Forschung war sicherlich die Entdeckung, dass a) die Barrierelipide überwiegend aus Ceramiden (CER), Cholesterin (CHOL), freien Fettsäuren (FFA) zusammengesetzt sind und b) sie in einer molaren Menge von 1:1:1 vorliegen. Außer Cholesterin, sind aber Ceramide und freie Fettsäuren zusätzlich in unterschiedlichen Kettenlängen und die Ceramide weiter in unterschiedlichen Klassen vorhanden.
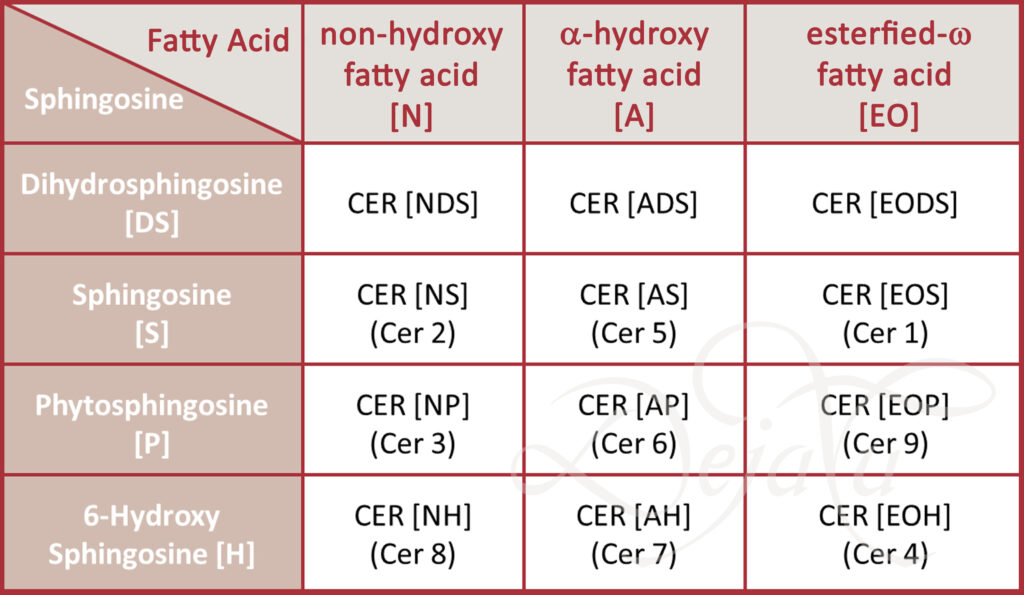
Zunächst wurden die Ceramide durchnummeriert (von 1 bis 9). Heute benennt man sie mit Kürzeln, die Hinweise auf ihre Struktur geben Abb 2. Ceramide gelten als die relevanten Barrierelipide, die für den „richtigen“ Abstand zwischen den Lipiddoppelschichten verantwortlich sind (8). In Untersuchungen zu Atopischer Dermatitis wurde entdeckt, dass Ceramide verringert sind (9). Es wurde lange diskutiert, ob nur die geringere Menge oder auch eine verringerte Kettenläge die relevanten Faktoren seien (10).
In vielen Studien zu Atopischer Dermatitis lassen sich die defekten Barriereeigenschaften mittels TEWL nachweisen und mit der Zusammensetzung der Barrierelipide korrelieren (11).
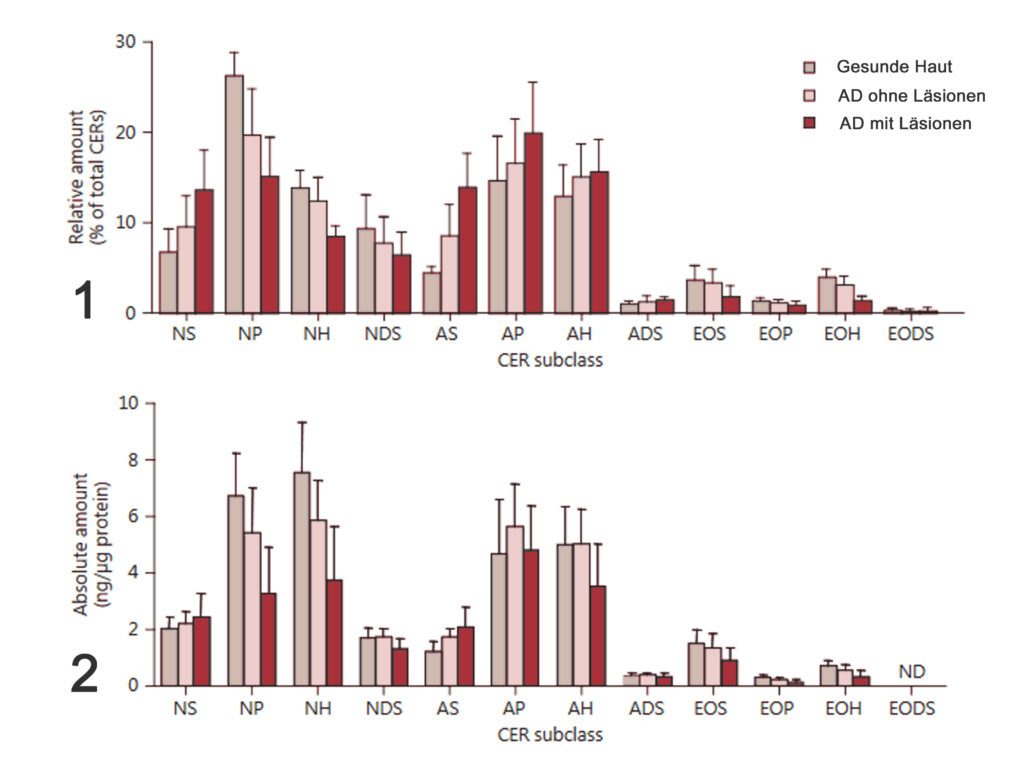
Kollektiv 1 ist aus einer Studie mit „kaukasischen“ Probanden und Kollektiv 2 mit asiatischen. Weiterhin ist in für das erste Kollektiv der auf den Gesamtceramid-Gehalt referenzierte Anteil der verschiedenen Ceramid Fraktionen angegeben. Für das zweite die absolute Menge.
Wenn man annimmt, dass sich europäische und asiatische Kollektive in punkto Barriere nicht unterscheiden, zeigt sich, dass unverzweigte gesättigte Ceramide relevant für die Barriere sind und Ceramide mit der Esterfizierung an der Omega Position (Ceramid1 ) relativ wenig vorhanden sind. Dennoch lassen sich offenbar Mängel in der lamellaren Struktur genau auf diese Ceramid-Gruppen zurück führen. Das legt den Schluss nahe, dass diese Effekte nicht erst im Stratum Corneum auftreten, sondern systemische Veränderungen dafür verantwortlich sind. Quelle (11).
Weiterhin wird in atopischer Haut beobachtet, dass sowohl bei den Fettsäuren als auch bei den Ceramiden die langkettigen Anteile verringert und die kurzkettigen erhöht sind (8).
Die biochemischen Prozesse im Stratum Corneum
Die Epidermis ist ein hochdynamisches Gewebe, bei dem von der Basalschicht aus neue Zellen gebildet werden, die kontinuierlich nach oben wandern und dabei Funktion und Struktur verändern. Die Differenzierung der Epidermis folgt nach angelegten genetischen Mustern, in denen für jeden Schritt bestimmte Enzyme zum Einsatz kommen. Die freien Fettsäuren werden dabei in der Basalmembran gebildet, die Umwandlung der polaren Membranlipide der Kerationozyten in unpolare Barrierelipide findet in dem Stratum Granulosum statt. Sie wird durch verschiedene Enzyme gesteuert. Man vermutet heute, dass eine Störung in der Verlängerung der Kohlenstoffketten eine der Ursachen für Atopische Dermatitis ist.
Wichtig ist dabei zu beachten, dass nicht nur die Lipidsynthese in der Haut, sondern auch andere Stoffwechselvorgänge relevant zur Ausbildung einer funktionierenden Hautbarriere notwendig sind (12), auf die ich hier nicht weiter eingehe.
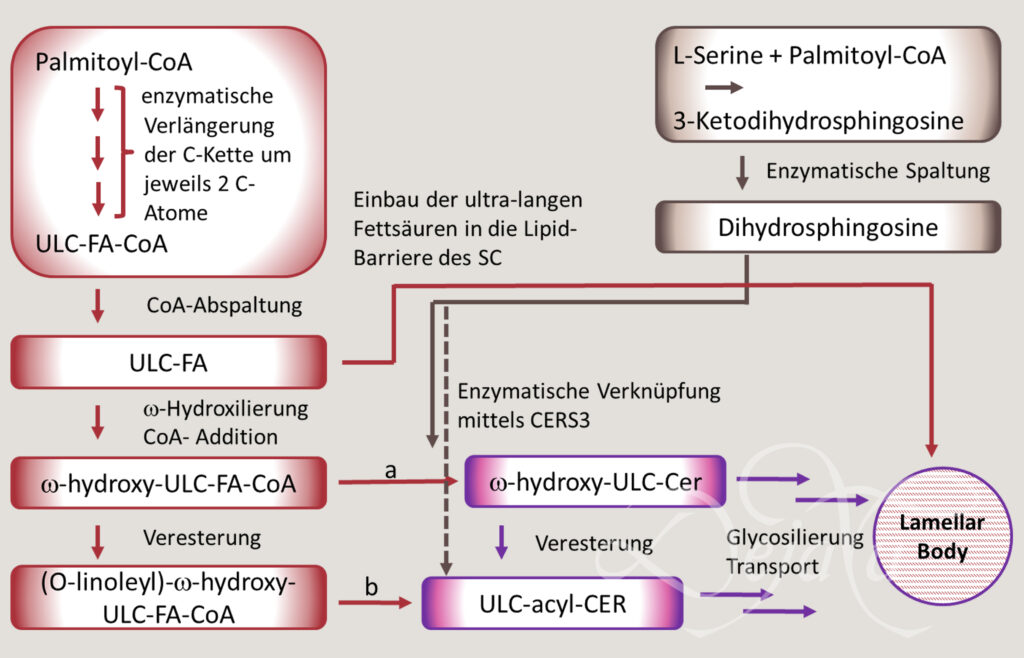
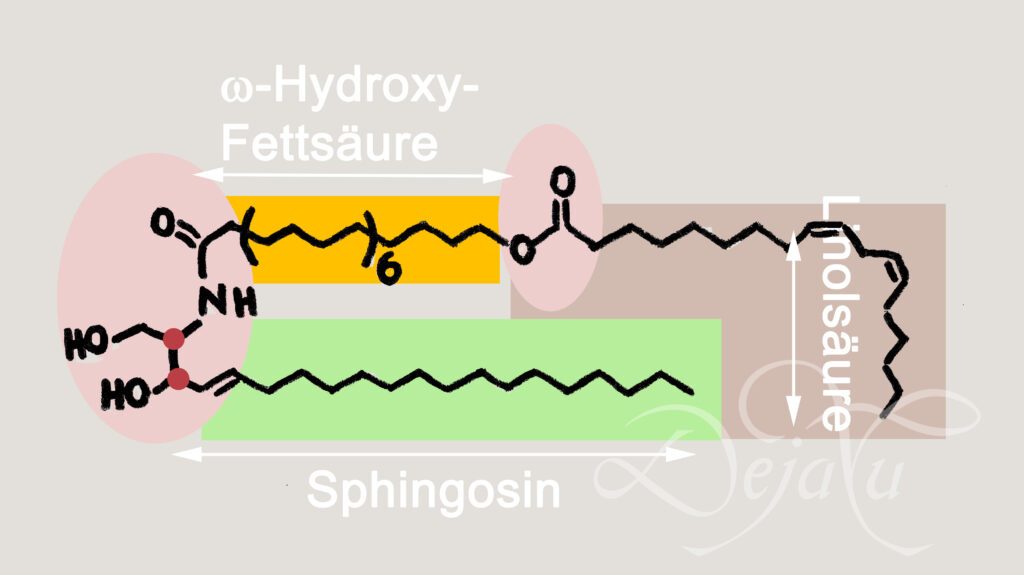
Zunächst werden in den Keratinozyten die Kettenlängen der an Coenzym A (CoA) gebundenen Fettsäuren verlängert. Dabei ist das Enzym ELOVL4 dasjenige, das besonders lange Kohlenstoffketten erzeugen kann. Langkettige Fettsäuren gehen nicht alleine in die Ceramidsynthese, sondern auch „direkt“ in die Lipidmembranen. Nach der ω-Hydroxylierung und Komplexierung mit CoA kann die Fettsäure mit Dihydrosphingosine zu dem Ceramid verknüpft werden. Dafür verantwortlich ist das Enzym CERS3, das spezialisiert ist auf die Verknüpfung von langkettigen Reaktanden. Wann die für die Synthese von Ceramid1 notwendige Versterung der Linolsäure statt findet, wird noch diskutiert. Vorstellbar sind zwei Wege, a) zunächst die Umsetzung zum Ceramid und danach die Veresterung oder b) zuerst die Veresterung und dann die Umsetzung zum Ceramid. Nach allen Reaktionsschritten befinden sich die Ceramide als Glucosylceramdie in den Lamellar Bodies, wo sie enzymatisch gespalten werden.
Wie die Lipide aus den Lamellar Bodies in die Zellzwischenräume des Stratum Corneum gelangen
Während die „Ausschleusung“ der Barrierelipide aus den Lamellar Bodies lange so dargestellt wurde, als ob die fertigen Lamellen einfach in die Zellzwischenräume der Corneozyten gedrückt würden – wie die Zahnpasta aus der Tube – ist heute ein tiefergehendes Verständnis für die Mechanismen vorherrschend.
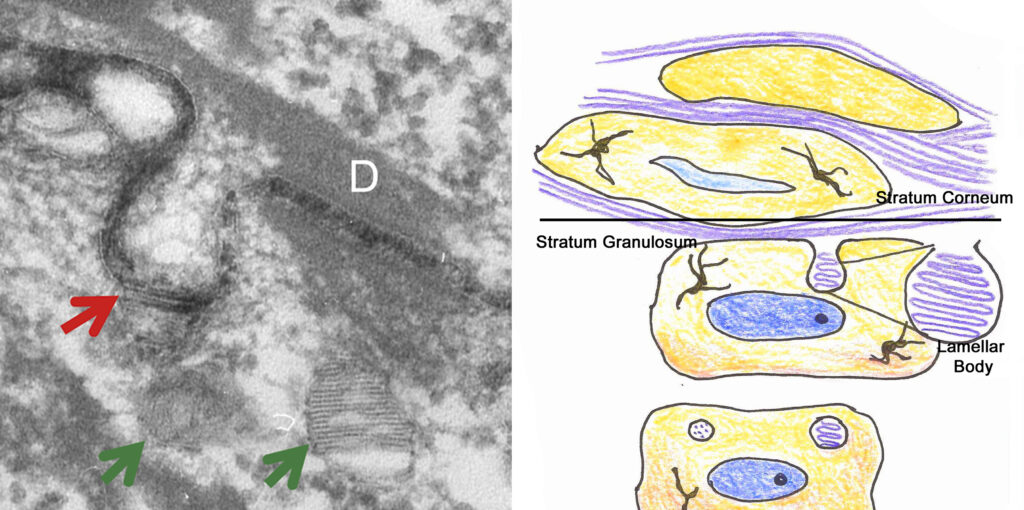
Damit die Barrierelipide überhaupt wirken können, müssen die Glucosyl-Ceramide deglycolisiert werden. Dafür sind bestimmte Enzyme notwendig. So wurde lange angenommen, dass sich diese polaren Vorläufer der Ceramide in einer mono-Schicht an dem Corneozyten anordnen und dann sukzessive deglycolisiert werden. Diese Idee wird auch mit dem Corneocyte Lipide Envelope beschrieben (17). Dafür werden w-hydroxy-Ceramide und w-hydroxy-acyl-Ceramide als die relevanten Substanzen angesehen.
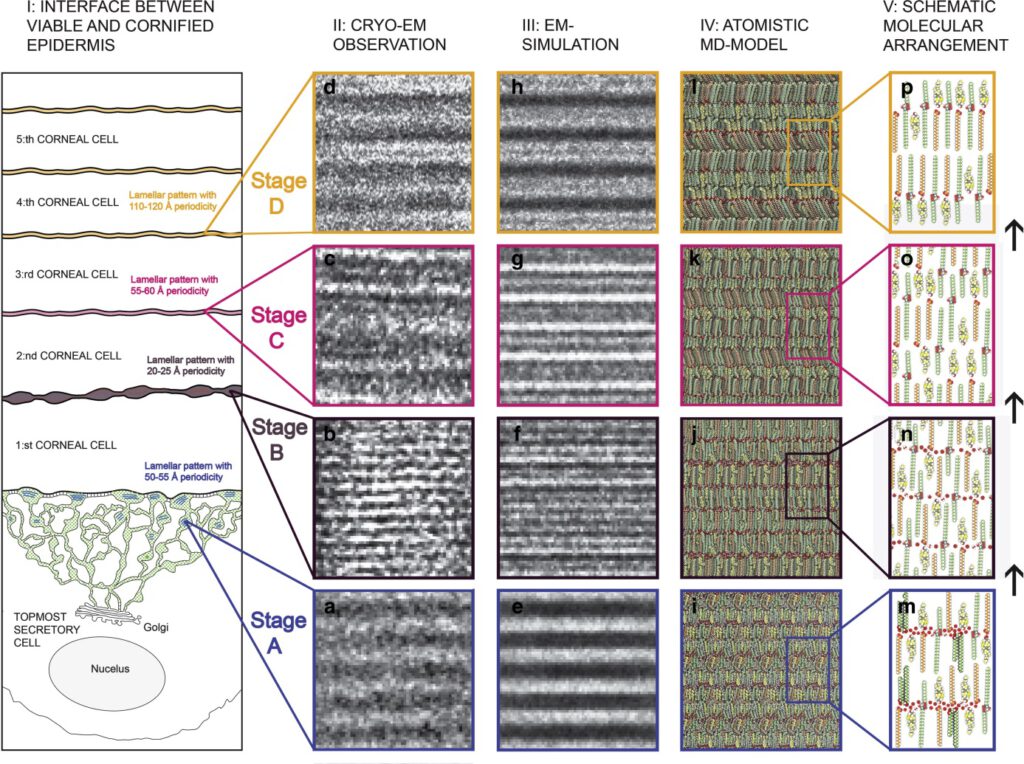
Dagegen konnten Norlén et al. nachweisen, dass der Vorgang offenbar deutlich komplexer ist und nicht alleine im Übergang vom Stratum Granulosum zum Stratum Corneum statt findet (18), sondern bis in die Hornschicht hinein reicht (Abb. 6). Dabei werden die unteren fünf Schichten des Stratum Corneums miteinbezogen. Mit fortschreitender enzymatischer Deglycolisierung ändern die Ceramide nicht nur die Polarität, sondern auch ihre Konformation und entfalten sich der Länge nach (Abb 7). Die Lipid-Doppelschichten werden also erst nach und nach ausgebildet und sind nicht schon in den Lamellar Bodies vorhanden.
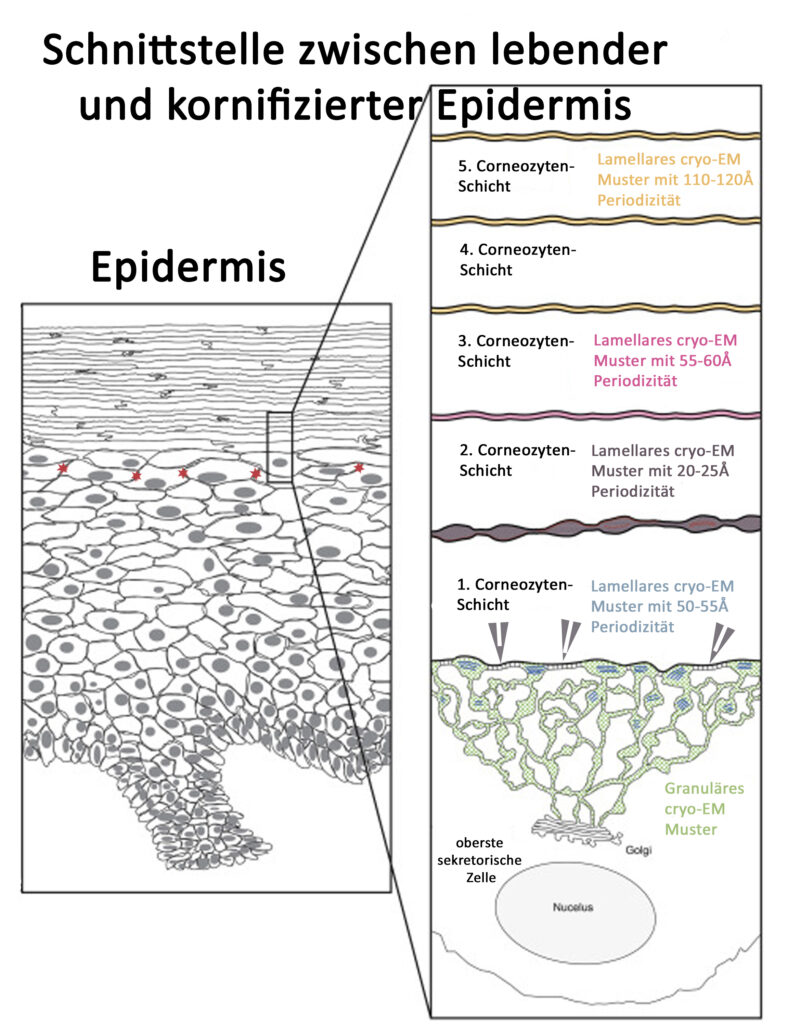
Bei einer Anzahl von ca 20 Schichten an Corneozyten ist also die Lipidbarriere in dem unteren fünftel noch gar nicht komplett ausgebildet.
Fazit
Seit ich mich vor über 25 Jahren in meiner beruflichen Laufbahn mit dem Stratum Corneum beschäftigt habe, läßt mich dieses Thema nicht los. Auch in Artikeln bei Pinkmelon und in Vorträgen des I.A.C. ist das Stratum Corneum ein wiederkehrendes Thema. Sein Aufbau, seine Funktion und die Rolle der Barrierelipide sind wichtige Aspekte auch für die Hautpflege. Die Forschung zu dem Thema Hautbarriere hat allerdings weniger den Zweck des Erkenntnisgewinns, sondern ist vielmehr getrieben davon, Möglichkeiten zu finden, Wirkstoffe über die Haut in den Organismus zu bringen. Den brauchbaren Nebeneffekt, ein tieferes Verständnis für Hauterkrankungen wie Atopische Dermatitis oder Psoriasis nimmt man gerne mit. Auch wenn diese Hauterkrankungen einen hohen volkswirtschaftlichen Schaden erzeugen, das allein würde nicht die vielen Millionen Euro rechtfertigen, die in die Untersuchungen der Hautbarriere geflossen sind.
Immer deutlicher wird aber auch, dass die Zusammensetzung der Barrierelipide von einem fein abgestimmten Zusammenspiel an verschiedenen Enzymen abhängig ist. In neuere Untersuchungen zeigen sich Hinweise, dass dieses Zusammenspiel durch entzündliche Prozesse in der Haut beeinträchtigt werden kann (11). So entsteht dann ein Teufelskreis, der häufig nur noch durch systemische Medikation durchbrochen werden kann. Derzeit wird stark vermutet, dass das Hautmikrobioms sowie die Ernährung deutliche Einflüsse haben.
Literatur
(1) Murphrey MB, Miao JH, Zito PM, Histology, Stratum Corneum. [Updated 2022 Nov 14]. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2023 https://www.ncbi.nlm.nih.gov/books/NBK513299/
(2) Kligman, A.M. (2011), Corneobiology and Corneotherapy – a final chapter. International Journal of Cosmetic Science, 33: 197-209 https://onlinelibrary.wiley.com/doi/full/10.1111/j.1468-2494.2011.00644.x
(3) Marks, R. (2014), The stratum corneum: a moving subject. Br J Dermatol, 171: 10-12 https://onlinelibrary.wiley.com/doi/10.1111/bjd.13252
(4) Elias PM, Feingold KR, Stratum Corneum Barrier Function: Definitions and Broad Concepts in Skin Barrier (2006) CRC Press https://www.taylorfrancis.com/chapters/edit/10.1201/b14173-4/stratum-corneum-barrier-function-definitions-broad-concepts-peter-elias-kenneth-feingold
(5) Norlén L; Current Understanding of Skin Barrier Morphology. Skin Pharmacol Physiol 1 July 2013; 26 (4-6): 213–216 https://karger.com/spp/article-abstract/26/4-6/213/295969/Current-Understanding-of-Skin-Barrier-Morphology?redirectedFrom=fulltext
(6) Yoshida T, Beck LA, De Benedetto A, Skin barrier defects in atopic dermatitis: From old idea to new opportunity, Allergology International, Volume 71, Issue 1 (2022), 1-13 https://www.sciencedirect.com/science/article/pii/S1323893021001453
(7) Norlén L, Lundborg M, Wennberg C, Narangifard A, Daneholt B. The Skin’s Barrier: A Cryo-EM Based Overview of its Architecture and Stepwise Formation. J Invest Dermatol. 2022 Feb;142(2):285-292 https://pubmed.ncbi.nlm.nih.gov/34474746/
(8) Bouwstra JA, Gooris GS, Dubbelaar FER, Weerheim Am, IJzerman AP, Ponec M, Role of ceramide 1 in the molecular organization of the stratum corneum lipids, Journal of Lipid Research, Volume 39, Issue 1 (1998) 186-196 https://www.sciencedirect.com/science/article/pii/S0022227520342140
(9) Di Nardo A; Wertz P; Alberto G; Seidenari S, Ceramide and cholesterol composition of the skin of patients with atopic dermatitis, ACTA DERMATO-VENEREOLOGICA, 78:(1998), pp. 27-30 https://iris.unimore.it/handle/11380/613003
(10) Yamamoto, A., Serizawa, S., Ito, M. et al. Stratum corneum lipid abnormalities in atopic dermatitis. Arch Dermatol Res 283, 219–223 (1991) https://link.springer.com/article/10.1007/BF01106105
(11) van Smeden J, Bouwstra JA, Stratum Corneum Lipids: Their Role for the Skin Barrier Function in Healthy Subjects and Atopic Dermatitis Patients, Skin Barrier Function (2016) 8-26 , T. Agner Ed. S. Karger AG https://karger.com/books/book/162/chapter-abstract/5099221/Stratum-Corneum-Lipids-Their-Role-for-the-Skin?redirectedFrom=fulltext
(12) Ishida-Yamamoto A, Igawa S. The biology and regulation of corneodesmosomes. Cell Tissue Res. 2015 Jun;360(3):477-82. https://pubmed.ncbi.nlm.nih.gov/25407522/
(13) Akiyama, M. (2021), Acylceramide is a key player in skin barrier function: insight into the molecular mechanisms of skin barrier formation and ichthyosis pathogenesis. FEBS J, 288: 2119-2130 https://febs.onlinelibrary.wiley.com/doi/full/10.1111/febs.15497
(14) Shu H, Peng Y, Hang W, Li N, Zhou N (2022). Emerging Roles of Ceramide in Cardiovascular Diseases. Aging and disease. 13. 232 https://www.researchgate.net/publication/358033958_Emerging_Roles_of_Ceramide_in_Cardiovascular_Diseases
(15) Raichur S, (2020) Ceramide Synthases Are Attractive Drug Targets for Treating Metabolic Diseases. Frontiers in Endocrinology. 11. https://www.researchgate.net/publication/343289968_Ceramide_Synthases_Are_Attractive_Drug_Targets_for_Treating_Metabolic_Diseases
(16) Breiden B, Sandhoff K, (2013). The role of sphingolipid metabolism in cutaneous permeability barrier formation. Biochim Biophys Acta S1388-1981:00170-00174 https://www.researchgate.net/publication/255974954_Breiden_B_Sandhoff_KThe_role_of_sphingolipid_metabolism_in_cutaneous_permeability_barrier_formation_Biochim_Biophys_Acta_S1388-198100170-00174
(17) Elias PM, Gruber R, Crumrine D, Menon G, Williams ML, Wakefield JS, Holleran WM, Uchida Y. Formation and functions of the corneocyte lipid envelope (CLE). Biochim Biophys Acta. 2014 Mar;1841(3):314-8 https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3943821/
(18) Narangifard A, den Hollander L, Wennberg CL, Lundborg M, Lindahl E, Iwai I, Han H, Masich S, Daneholt B, Norlén L. Human skin barrier formation takes place via a cubic to lamellar lipid phase transition as analyzed by cryo-electron microscopy and EM-simulation. Exp Cell Res. 2018 May 15;366(2):139-151 https://pubmed.ncbi.nlm.nih.gov/29567114/
(19) Norlen L, Lundborg M, Wennberg C, Narangifard A, Daneholt B, The Skin’s Barrier: A Cryo-EM based Overview of its Architechture and Stepwise Formation, J.Ivest.Derm (2022) Vol 142, 285-292 https://www.jidonline.org/article/S0022-202X(21)01687-0/fulltext
(20) Narangifard A, Wennberg CL, den Hollander L, Iwai I, Han H, Lundborg M, Masich S, Lindahl E, Daneholt B, Norlén L, Molecular Reorganization during the Formation of the Human Skin Barrier Studied In Situ, Journal of Investigative Dermatology, Volume 141, Issue 5 (2021), 1243-1253 https://www.sciencedirect.com/science/article/pii/S0022202X20321904
Bildnachweise
Titelbild: Shutterstock Stock-Foto ID: 1921888961
Abbildung 1: wikimedia https://en.wikipedia.org/wiki/Benign_tumor#/media/File:Normal_Epidermis_and_Dermis_with_Intradermal_Nevus_10x.JPG
Abbildung 2, 3, 5, 6: eigene Werke Nutzung unter der Creative Commons Lizenz CC BY-SA 3.0
Abbildung 4 adaptiert aus 11
Abbildung 6 adaptiert aus wikipedia
Abbildungen 7, 8: Norlen et al gemeinfrei unter https://creativecommons.org/licenses/by/4.0/ farblich angepasst und ins Deutsche übersetzt