Innerhalb des vergangenen Jahrzehnts hat sich unser Wissen um die bakterielle Zusammensetzung des Mikrobiom des Mundraumes (das orale Mikrobiom) enorm erweitert. Mit Hilfe moderner Analysenmethoden wie der Metagenom Shotgun Analytik oder der 16rRNA Sequenzierung konnten auch Keime identifiziert werden, die sich nicht kultivieren lassen. Damit wurde das Wissen um den Mund, Hygiene und Zahnreinigung erheblich vergrößert.
Das orale Mikrobiom ist kein homogenes Gebilde, sondern setzt sich aus vielen verschiedenen bakteriellen Kolonien zusammen. Diese variieren je nach Habitat im Mundraum. Außer Bakterien leben in dieser Umgebung auch Pilze, Viren, Arachaen und Protozoen (1). Im Mundraum wurden über 700 verschiedene bakterielle Spezies identifiziert, allerdings sollen bei gesunden Individuen lediglich 250 bis 300 Spezies vorhanden sein. Die am häufigsten vorkommenden Keime sind vom Genus Streptococcus (2).
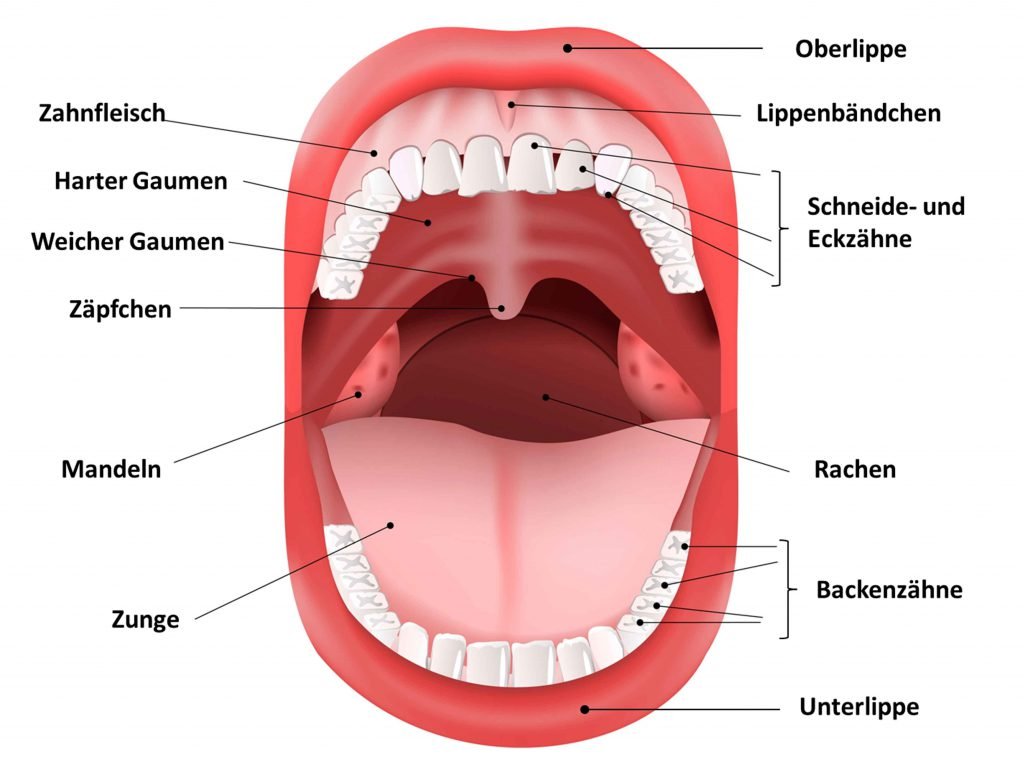
Abbildung 1: Die verschiedenen Areale des Mundraumes. Im Wesentlichen werden unterschieden Oberflächen, die sich erneuern wie die Schleimhäute, Zunge und Mandeln und Oberflächen, und die sich nicht erneuern wie die Zähne, Implantate und Füllungen.
Gib dem Affen Zucker!
Allen voran ist es Zucker, der unseren Zähnen an den Hals will. Er ist der Hauptverursacher von Karies. Zucker verändert die Zusammensetzung des Mikrobioms derart, dass zunehmend Säuren produziert werden und damit Ca-Ionen und Phosphat aus dem Zahnschmelz gelöst werden (3). Das sind also nicht nur Kuchen und Eiscreme, die das befördern, sondern gerade auch Säure- und Zuckerhaltige Getränke. Cola, Wein und sogar Sprudelwasser stehen derzeit auf der Verdachtsliste (4). Sie verändern den oralen pH Wert von normalen 6-7,5 ins Saure. Damit wird eine Dysbiose induziert, Säure liebende Bakterien vermehren sich und können in den Biofilm eindringen. Dieser wird auf jeder Oberfläche gebildet. Letztendlich begünstigen sie dann eine Demineralisierung des Zahnschmelzes und erleichtern es Bakterien wie Streptococcus mutans, sobrinus und Lactobacillus, sich auf der Zahnoberfläche nieder zu lassen und die typischen Karies-Läsionen zu erzeugen.
Da bleibt dir die Spucke weg – wie der Speichel den Biofilm macht
Es geht um den Biofilm. Er ist weiteres Schlagwort der Mikrobiomforschung. Der Biofilm ist ein Gemenge aus Proteinen, Bakterien und deren Stoffwechselprodukten, und haftet gerne auf allen möglichen Oberflächen. Besonders bevorzugt sind solche, deren Zellen sich nicht ständig erneuern. Hallo Zahnschmelz! Dort wird der Biofilm irgendwann zu Plaque (1, 5).
Natürlich bildet sich auch auf den gesamten Schleimhäuten des Mundraumes ein Biofilm (5, 6). Der wird fast schon liebevoll Pellikula genannt. Und seine Zusammensetzung wird gesteuert durch den Speichel. Wenn dieser reichlich fließt ist eigentlich alles im Fluss. Denn im Speichel befinden sich neben ganz viel Wasser auch etliche andere und vor allem nützliche Stoffe: Pufferkomponenten, Proteine, Mucine, Enzyme, Immunoglobuline und andere (6).
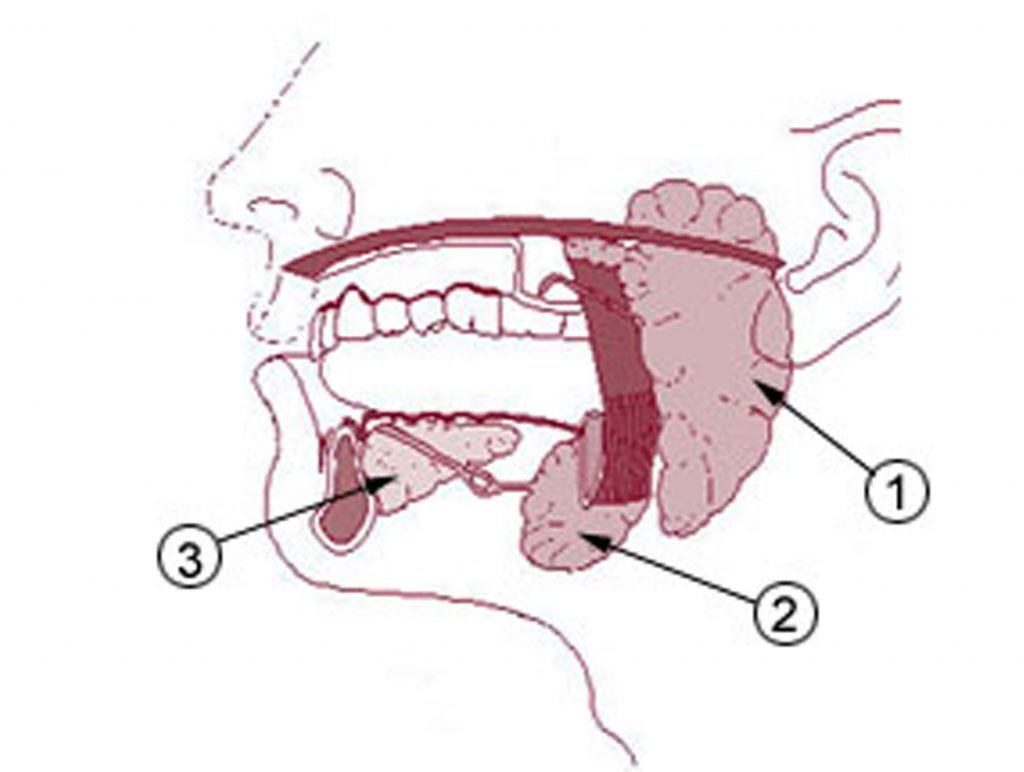
Abbildung 2: Die verschiedenen Speicheldrüsen, die den Mundraum „beliefern“ aus Wikipedia https://en.wikipedia.org/wiki/Salivary_gland#/media/File:Illu_quiz_hn_02.jpg . 1: Ohrspeicheldrüse, Glandular Parotidea, ist die größte der Speicheldrüsen und für etwa 20% des Speichels verantwortlich. Sie enthält große Mengen an Amylase und ist wichtig für die Nahrungszerkleinerung. 2. Unterkieferspeicheldrüse, Gladular Submandibularis, sezerniert etwa 65-70% % des Speichels, der eine Kombination aus Serum und Schleim ist. 3. Unterzungenspeicheldrüse, Glandular Sublingualis, ist zwar nur für etwa 5% des Speichels verantwortlich, dafür enthält dieser aber auch den höchsten Anteil an Mucinen.
Der Speichel umspült also nicht nur alle Habitate des Mundraumes, er sorgt auch für den Abtransport von abgeschilferten Zellen und damit von den daran haftenden Bakterien. 0,6l Speichel produzieren wir durchschnittlich pro Tag (6).
Lediglich an den Zähnen, die ja nicht abschilfern und so ihre Oberfläche erneuern, wächst der Biofilm an. Den bekommt man dann nur mechanisch weg.
Breaking bad – vom kommensalen zum pathogenen
Doch es gibt Nischen … Wenn diese schlecht von Speichel durchspült werden, können sich anaerobe Bakterien festsetzen und ansiedeln. Dann kann es zu Parodontose kommen. Die angesiedelten Bakterien verändern ihre Umgebung und machen es damit anderen eher pathogen wirkenden Spezies leichter, dazu zu kommen. Etwa so wie bei der AFD.
Besonders empfindliche Bereiche sind das Zahnbett, werden die sogenannten Taschen größer, ist das ein Zeichen für Parodontose. Als ein solcher befördernder Keim gilt Porphyromonas gingivalis.
Zwar kann man einige Keime dem entzündlichen Geschehen zuordnen, doch ist es nicht ihre Menge, die zu der Dysbiose führt, sondern ihre subtilen Veränderungen der Umgebung (7).
Man hat weiter Abstriche gesunder Probanden gesammelt und den für Parodontose günstigen Bedingungen unterworfen. Und, obwohl am Anfang der Untersuchung keine pathogenen Keime nachweisbar waren, nach drei Wochen waren sie aus dem ursprünglich gesunden Mikrobiom gewachsen. Daraus entwickelten die Forscher die sogenannte ecological plaque hypothesis. Veränderungen in der Umgebung sind dafür verantwortlich, dass pathogene Keime sich vermehren können (8).
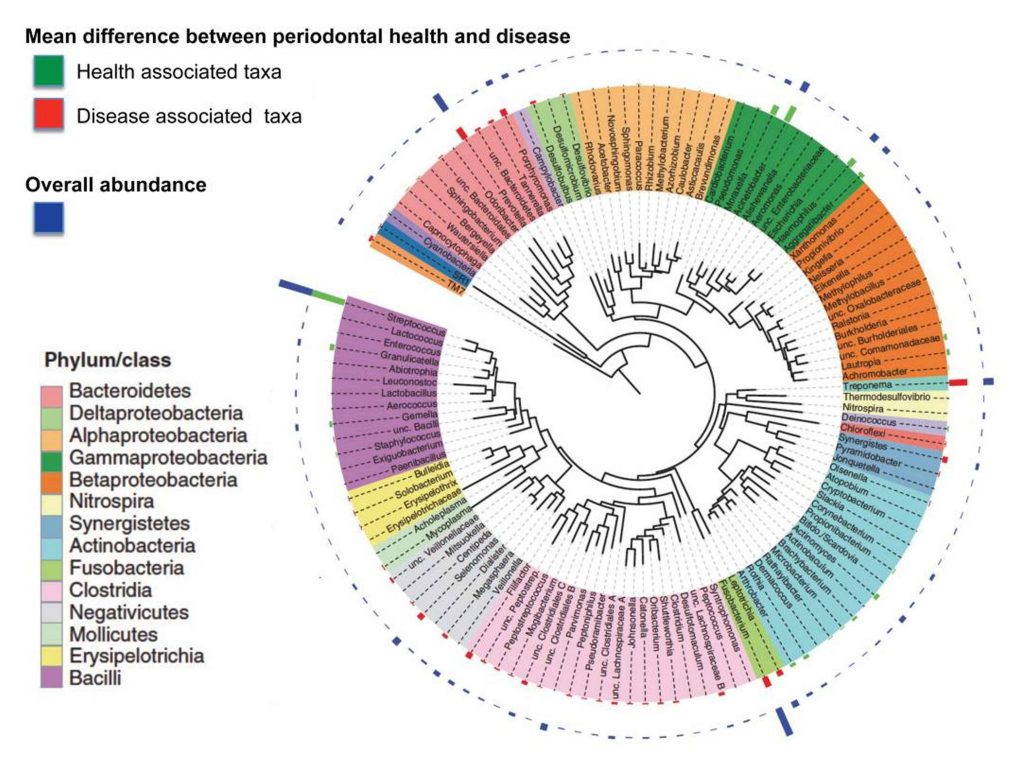
Abbildung 3: Betrachtung der wesentlichen bakteriellen Phylae im oralen Mikrobiom: Relative Häufigkeit und Beiträge zur Gesundheit bzw. Krankheit (2). In diesem Fall für Parodontose.
Wie wir selber zur Veränderung des oralen Mikrobioms beitragen
Ob wir nun Karies bekommen oder Parodontose, hängt auch stark davon ab, wie wir uns verhalten. Natürlich gibt es eine genetische Komponente, doch das gros ist hausgemacht (9). Zucker, ja hatten wir schon, korreliert positiv mit Karies. Rauchen, hatten wir noch nicht erwähnt, korreliert positiv mit Parodontose und Zahnfleischentzündungen. Die Einnahme von Medikamenten häufig mit verringertem Speichelfluss.
So wundert es denn auch nicht, dass unsere neolithischen Vorfahren trotz fehlender Zahnbürste ein gesünderes orales Mikrobiom besessen haben als wir (10). Diese Befunde konnten auch am naturnahen Volk der Batwa, Jäger und Sammler aus Uganda, bestätigt werden (11).
Obwohl Hygiene ein ganz wichtiger Faktor zur Vermeidung von Karies ist, schadet eine übertriebene Hygiene manchmal mehr als sie nutzt.
Wie das orale Mikrobiom den Blutdruck senkt
So wird mittlerweile die Verwendung von Mundspülungen eher von nicht sinnvoll bis schädlich eingestuft. Besonders die Verwendung von Chorhexidin haltigen Mundspülungen korreliert positiv mit Diabetes (12, 13). Dieser Befund brachte es vor zwei Jahren in die Schlagzeilen. Kritische Kommentatoren bemängelten die statistische Auswertung. Erwiesen ist jedoch, dass Chlorhexidin haltige Mundspülungen den Blutdruck ansteigen lassen (14) Dieser Sachverhalt lässt sich damit erklären, dass alle antibakteriell wirkenden Substanzen nicht selektiv auf das Mikrobiom wirken. Es werden alle Bakterien verringert, auch solche, die den pH Wert erhöhen und solche, die Nitrat verstoffwechseln. Und natürlich auch solche, die Stickstoffmonoxid (NO) synthetisieren. Und genau das passiert auch im Mundraum.
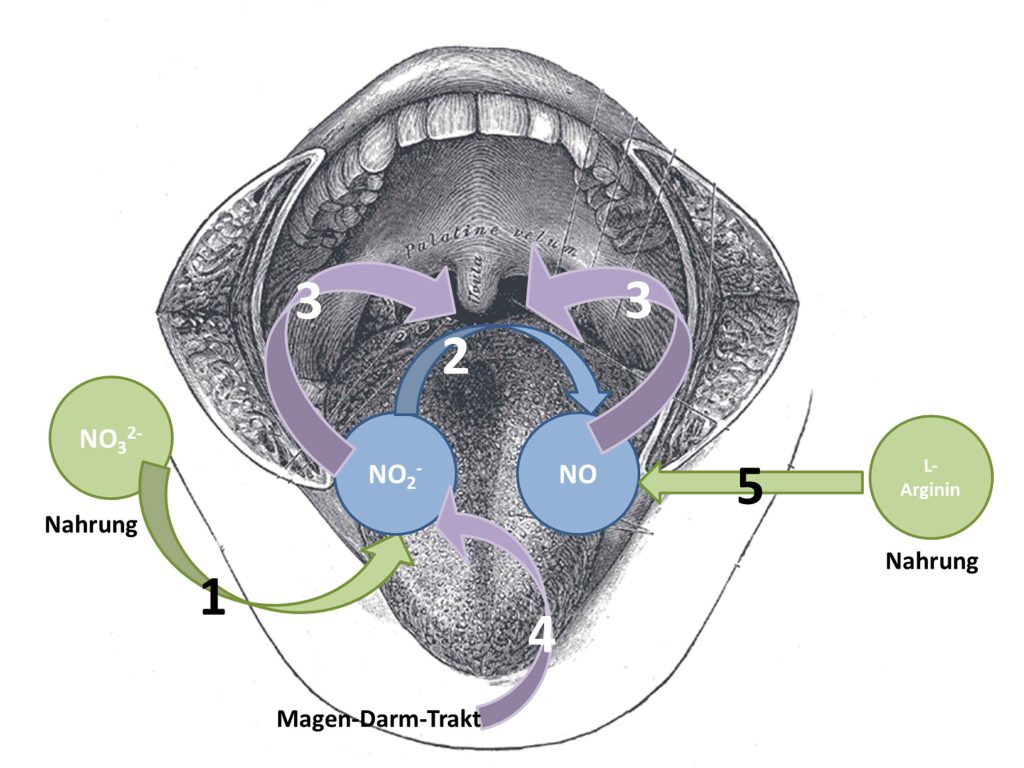 Abbildung 4: Verstoffwechselung von Nitrat zu Nitrit und zu NO findet sowohl im Darm als auch im Mundraum statt. Bei dem mit der Nahrung aufgenommenen Nitrat gelangt das meiste in den Magen- Darm-Trakt (1). Dort wird es zu Nitrit reduziert und zu etwa 75% über die Nieren ausgeschieden. Etwa 25% des Nitrits wird über den Speichelfluß zurück in den Mundraum gespült (4), wo es von den geeigneten Bakterien weiter reduziert wird (2) und als NO in den Magen-Darm-Trakt gelangt (3). NO kann auch direkt aus Aminosäuren von geeigneten Bakterien synthetisiert werden (5). Im Magen-Darm-Trakt wird es aufgenommen und führt zur Vasodilatation, einer Erweiterung der Blutgefäße, was eine Verringerung des Blutdrucks zur Folge hat. Bild adaptiert aus Wikipedia https://upload.wikimedia.org/wikipedia/commons/6/6e/Gray1014.png
Abbildung 4: Verstoffwechselung von Nitrat zu Nitrit und zu NO findet sowohl im Darm als auch im Mundraum statt. Bei dem mit der Nahrung aufgenommenen Nitrat gelangt das meiste in den Magen- Darm-Trakt (1). Dort wird es zu Nitrit reduziert und zu etwa 75% über die Nieren ausgeschieden. Etwa 25% des Nitrits wird über den Speichelfluß zurück in den Mundraum gespült (4), wo es von den geeigneten Bakterien weiter reduziert wird (2) und als NO in den Magen-Darm-Trakt gelangt (3). NO kann auch direkt aus Aminosäuren von geeigneten Bakterien synthetisiert werden (5). Im Magen-Darm-Trakt wird es aufgenommen und führt zur Vasodilatation, einer Erweiterung der Blutgefäße, was eine Verringerung des Blutdrucks zur Folge hat. Bild adaptiert aus Wikipedia https://upload.wikimedia.org/wikipedia/commons/6/6e/Gray1014.png
Die systemische Wirkung des oralen Mikrobioms
Im Zuge der Mikrobiomforschung treten immer weiter reichende Erkenntnisse zu Tage. So sind auch beim oralen Mikrobiom Zusammenhänge von der Zusammensetzung des Mikrobioms mit systemischen Krankheiten offensichtlich geworden (15). Volkswirtschaftlich relevant ist die erwiesene Korrelation von Zahnbetterkrankungen (Parodontose) mit Diabetes, kardiovaskulären Erkrankungen und Fehlgeburten. Parodontose steht weiter im Verdacht Lungen- und Nierenerkrankungen, Schlaganfall und Krebs zu befördern (16). Rheumatoider Arthritis und andere sogenannte Autoimmunerkrankungen können ebenfalls auf Parodontose zurück geführt werden, bzw. werden durch sie verschlimmert.
Umgekehrt verbessert sich das entzündliche Geschehen im Mundraum, wenn die Erkrankung therapiert wird (17, 18).
Auch diagnostisch ist man heißen Markern auf der Spur, mittels derer man aufgrund der Zusammensetzung des oralen Mikrobioms Vorhersagen zu Krebserkrankungen treffen kann (19).
Aufgrund der neuesten Veröffentlichungen wird deutlich, dass die unterschiedlichen Mikrobiome alle systemische Wirkungen entfalten und miteinander rückkoppeln. Eine Dysbiose hat somit nicht nur lokale, sondern körperweit reichende Auswirkungen.
Wie können wir das orale Mikrobiom gesund erhalten?
Krankheit ist in vielen Fällen kein Schicksalsschlag, sondern die Folge hausgemachter Probleme (9). Auffällig ist, dass die Weichen schon beim Erstkontakt mit Nahrung im Mund gestellt werden. Für die Gesunderhaltung unserer Zähne, Zahnfleisch und Körper kann man aber einfache Dinge beherzigen:
- Regelmäßig Zähne putzen
- Reduktion des Zuckerkonsums
- Nichtraucher werden bzw. bleiben
- Gesund essen ist wichtiger als Mundspülungen zu verwenden.
- Besonders geeignete Nahrungsmittel zu sich nehmen: Gemüse, grüner Tee
- Die mechanische Entfernung des Plaques von den Zähnen effektiver als die chemische Bekämpfung
- Da eine Wechselwirkung von den systemischen Erkrankungen zu der Zusammensetzung des oralen Mikrobioms besteht, hilft auch eine Therapie der Erkrankungen
- Keine unnötigen Medikamente einnehmen, die zu verringertem Speichelfluss führen können
Es ist mir echt schon fast peinlich, dass am Ende meiner Artikel häufig so banale Sachen stehen. Die ganze Forschung betrieben wird, um uns am Ende zu sagen: Ernähre dich vernünftig! Aber was soll‘ s, so ist es.
Literatur
(1) Wade WG, The oral microbiome in health and disease, Phamacological Research,69 137-143 (2013) https://doi.org/10.1016/j.phrs.2012.11.006
(2) Costalonga M, Herzberg MC, The oral microbiome and the immunobiology of periodontal disease and caries, Immunology Letters, 162, (2), Part A,22-38 (2014) https://doi.org/10.1016/j.imlet.2014.08.017.
(3) Kilian M, Chapple ILC, Hannig, M, Marsh PD, Meuric V, Pedersen AML, Tonetti MS, Wade WG, Zaura E, The oral microbiome – an update for oral healthcare professionals, British Dental Journal, 221 (10) 657-666 (2016) ISSN 0007-0610
(4) https://www.today.com/health/sparkling-water-bad-your-teeth-dentists-weigh-t70761
(5) Lamont R.J, Koo H, Hajishengallis, G, The oral microbiota: dynamic communities and host interactions. Nat Rev Microbiol 16, 745–759 (2018) doi:10.1038/s41579-018-0089-x
(6) Lynge Pedersen AM, Belstrom D, The role of natural saliva defences in maintaining a healthy oral microbiota, Journal of Dentistry 80 Suppl.1, S3-S12 (2018) https://doi.org/10.1016/j.jdent.2018.08.010
(7) Marsh PD, Are dental diseases examples of ecological catastophes?, Microbiology 149 (2) 279-294 (2003)
(8) Naginyte M, Do T, Meade J, Devine DA, Marsh PD, Enrichment of periodontal pathogens from the biofilms of healthy adults. Sci Rep 9, 5491 (2019) doi:10.1038/s41598-019-41882-y
(9) Chapple ILC, Bouchard P, Cagett, MG, Campus G, Carra MC, Cocco F, Nibali L, Hujoe, P, Laine ML, Lingström P, Manton DJ, Montero E, Pitts N, Rangé H, Schlueter N, Teughels W, Twetman S, Van Loveren C, Van der Weijden F, Vieira AR, Schulte AG, Interaction of lifestyle, behaviour or systemic diseases with dental caries and periodontal diseases: consensus report of group 2 of the joint EFP/ORCA workshop on the boundaries between caries and periodontal diseases. J Clin Periodontol 44 (Suppl. 18): S39– S51 (2017). doi: 10.1111/jcpe.12685.
(10) Czichos J, Zahngesundheit verschlechtere sich seit der Jungsteinzeit, Wissenschaft aktuell, (2013) https://www.wissenschaft-aktuell.de/artikel/Zahngesundheit_verschlechterte_sich_seit_der_Jungsteinzeit1771015588963.html
(11) Nasidze I, Li J, Schroeder R, Creasey JL, Li M, Stoneking M, High Diversity of the Saliva Microbiome in Batwa Pygmies. PLoS ONE 6(8): e23352. (2011). https://doi.org/10.1371/journal.pone.0023352
(12) Joshipura KJ, Muñoz-Torres FJ, Morou-Bermudez E, Patel RP, Over-the-counter mouthwash use and risk of pre-diabetes/diabetes, Nitric Oxide,71,14-20 (2017) https://doi.org/10.1016/j.niox.2017.09.004.
(13) Preshaw PM, Mouthwash use and risk of diabetes, British Dental Journal, 225 (10) 923-926 (2018) https://www.nature.com/articles/sj.bdj.2018.1020.pdf?origin=ppub
(14) Tribble GD, Angelov N, Weltman R, Wang BY, Eswaran SV, Gay IC, Parthasarathy K, Dao DHV, Richardson KN, Ismail NM, Sharina IG, Hyde ER, Ajami NJ, Petrosino JF, Bryan NS, Frequency of Tongue Cleaning Impacts the Human Tongue Microbiome Composition and Enterosalivary Circulation of Nitrate, Frontiers in Cellular and Infection Microbiology, 9, 39-45 (2019) DOI=10.3389/fcimb.2019.00039
(15) Gao L, Xu T, Huang G, Jiang S, Gu Y, Chen F, Oral microbiomes: more and more importance in oral cavity and whole body, Protein Cell 9(5) 488-500 (2018)
(16) Nazir MA. Prevalence of periodontal disease, its association with systemic diseases and prevention. Int J Health Sci (Qassim), 11(2), 72–80 (2017).
(17) du Teil Espina M, Gabarrini G, Harmsen HJM, Westra J, van Winkelhoff AJ, van Dijl JM, Talk to your gut: the oral-gut microbiome axis and its immunomodulatory role in the etiology of rheumatoid arthritis, FEMS Microbiology Reviews 43 (1) 1–18 (2019), https://doi.org/10.1093/femsre/fuy035
(18) Kriebel K, Hieke, C, Müller-Hilke B, Nakata M, Kreikemeyer B, Oral Biofilms from Symbiotic to Pathogenic Interactions and Associated Disease –Connection of Periodontitis and Rheumatic Arthritis by Peptidylarginine Deiminase, Front. Microbiol. 9, (2018) https://doi.org/10.3389/fmicb.2018.00053
(19) Lim Y, Totsika M, Morrison M, Punyadeera C. Oral Microbiome: A New Biomarker Reservoir for Oral and Oropharyngeal Cancers. Theranostics.7(17):4313–4321. (2017). doi:10.7150/thno.21804
Bildnachweise
Titel. Eigenes Werk verwendbar unter der Creative Commons Lizenz CC BY-SA 3.0
Abbildung 1: Adaptiert aus Schutterstock https://www.shutterstock.com/de/image-vector/parts-human-mouth-open-white-healthy-220669927?src=library
Abbildung 2: Wikipedia https://en.wikipedia.org/wiki/Salivary_gland#/media/File:Illu_quiz_hn_02.jpg
Abbildung 3: (2) Costalonga https://doi.org/10.1016/j.imlet.2014.08.017 mit freundlicher Genehmigung
Abbildung 4: Adaptiert aus Wikipedia https://upload.wikimedia.org/wikipedia/commons/6/6e/Gray1014.png

