Der Markt der Anti-Aging Produkte brummt. Vor allen in China und den USA. Deutschland nimmt sich da relativ bescheiden aus mit einem Marktvolumen von 1,5 Milliarden USD im Jahr 2016 (1). Trotz Pandemie, die Vorhersagen zeigen auf weiteres Wachstum. Denn die Hautalterung ist die sichtbare Komponente des älter werdens. In allen Marktsegmenten gibt es daher zahlreiche kosmetische Produkte, die die Hautalterung verhindern oder verlangsamen sollen. In der plastischen Chirurgie ist sie genauso wichtig, wie bei Nahrungsergänzungsmitteln.
Es geht um mehr als Falten. Hier möchte ich mir die – im wahrsten Sinne – darunter liegenden Mechanismen der Hautalterung ansehen. Die Alterung des Bindegewebes, das Entstehen der Falten und warum, manche Leute einfach jünger aussehen.
Klassifikationsmöglichkeiten der Hautalterung
Die Hautalterung ist ein multifaktorielles Geschehen und ein höchst individueller Prozess. In der Dermatologie wird das Alterungsgeschehen als „pathologisch“ beschrieben und „Therapien“ verordnet.
Anleitungen zur Klassifikation von Falten im Gesicht sind gängig und deswegen fange ich mit ihnen an (2).
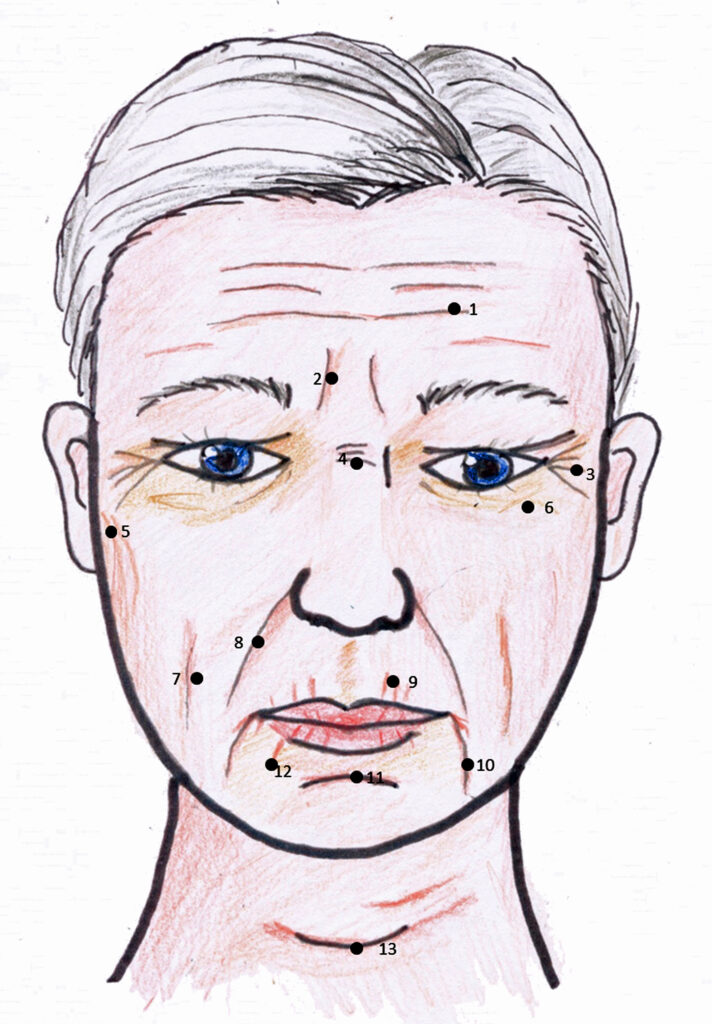
Falten:
- Horizontale Stirnfalten
- Glabellafalten (Zornesfalten)
- Krähenfüße
- Horizontale Glabellafalten
- Periauriculare Falten
- Periokulare Falten
- Wangenfalten
- Nasolabialfalte
- Radiale Oberlippenfalten
- Marionettfalten
- Labiomentale Falte
- Radiale Unterlippenfalte
- Halsfalte
Außer in Falten zeigt sich die Hautalterung aber noch in weiteren Bereichen. Insgesamt ist die Haut weniger strahlend, an manchen Stellen auch dunkler, meist im Augenbereich. Ebenfalls treten Pigmentflecken häufiger auf. Ein Erschlaffen der Haut tritt bei den Augenlidern und Wangen deutlich in Erscheinung. Die Haare wachsen spärlicher und werden grau. Bei manchen zeigen sich auch Verhornungsstörungen in Form von Mitessern.
Abbildung 1: Gesicht mit Falten und deren typischen Bezeichnungen, siehe dazu auch (2-4)
Falten sind zwar das wichtigste aber bei weitem nicht das einzige Zeichen der Hautalterung. Weitere Parameter sind das sogenannte „sagging“ (Erschlaffen der Haut), Pigmentveränderungen und Atrophie (Gewebeschwund) (4).
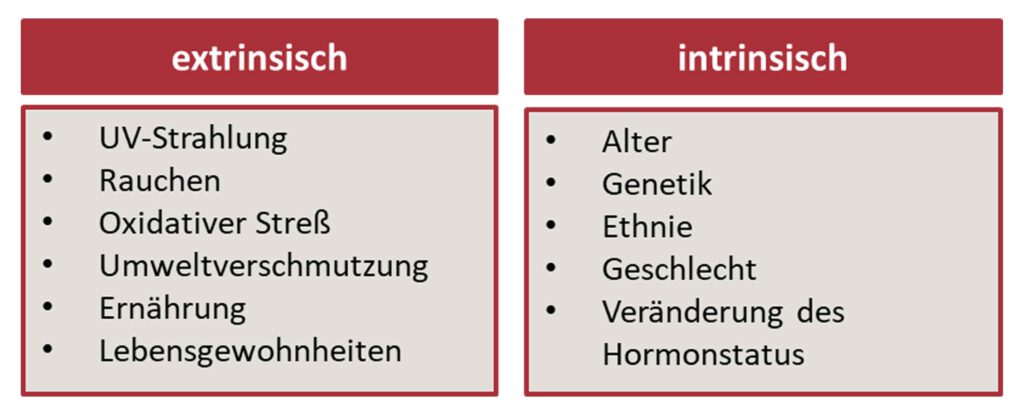
Zudem beeinflussen intrinsische und extrinsische Faktoren die Hautalterung nicht nur in der Entstehung, sondern auch ihren Verlauf.
Falten und Hautelastizität sind meßbare Parameter (6), die stark mit dem optischen Alter korrelieren. Pigmentflecken als Altersindiz fallen bei der Altersbeurteilung von Personen weniger ins Gewicht (3).
Die relevanten Alterungsprozesse der Haut finden in der Dermis, in der extrazellulären Matrix (ECM) statt. Und damit ist die Hautalterung definitiv kein oberflächliches Problem.
Das Bindegewebe der Haut und die Extra Cellular Matrix (ECM)
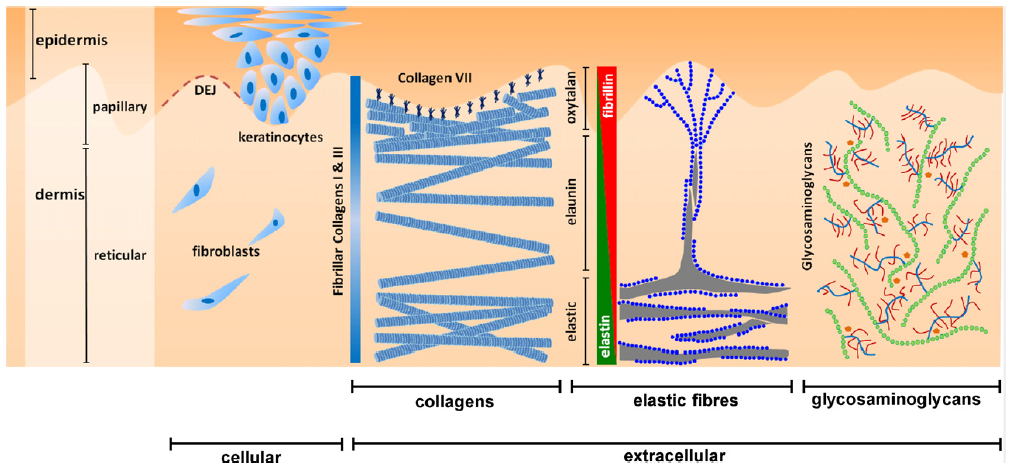
Die Haut ist als äußerstes Organ des Menschen in verschiedenen Schichten aufgebaut. In der Kosmetik beschäftigen wir uns mit der Behandlung der Epidermis und dort speziell mit der Hornschicht (Stratum Corneum) (9). Während die Epidermis wie die Haut selbst in Schichten aufgebaut ist, ist die darunter liegende Dermis nicht. Sie wird oft pauschal auch als Bindegewebe beschrieben, welches nicht nur in der Haut vorkommt, sondern in vielen Bereichen des Körpers (8-10).
Insgesamt befinden sich in der Dermis verschiedene Strukturen. Zunächst die Kollagene, die unterschiedliche Netzwerke verschiedener Festigkeit bilden. Darin eingebettet sind elastische Fasern, das Elastin und hygroskopische Gele, die aus Proteoglycanen speziell Hyaluronsäure gebildet werden. Sie zusammen bilden die extrazelluläre Matrix. Die Zellen, die diese Substanzen sezernieren, sind Fibroblasten, die sich im kollagenen Netzwerk der Dermis verteilen.
Die Verbindung von Epidermis zu Dermis wird in der Basalmembran (dermale epidermale Verbindung, DEJ) hergestellt. Hauptverantwortlich ist hier Kollagen IV.
Die Rolle der Kollagene
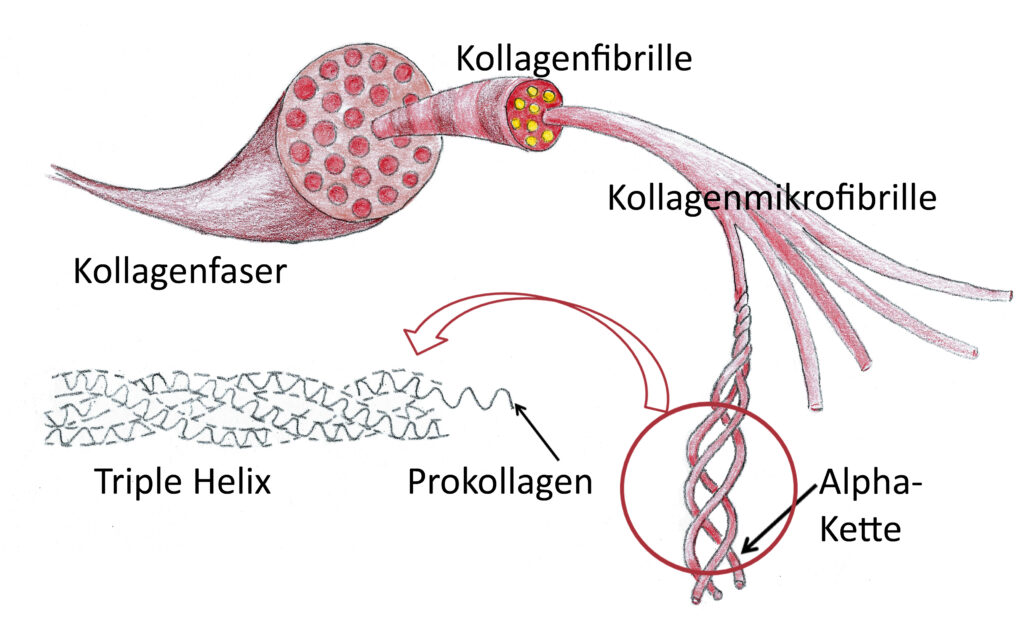
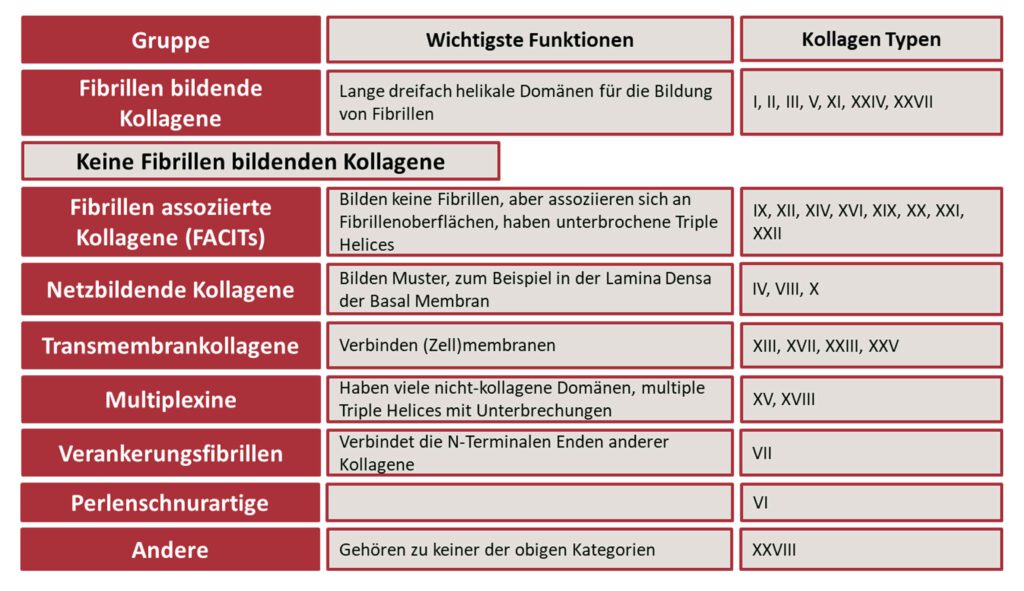
Kollagen ist das wichtigste Strukturprotein unseres Körpers. Kollagene kommen im Wesentlichen im Bindegewebe vor, aber auch Knochen, Zähne Knorpel und die Haut sind aus Kollagen aufgebaut. Bei Wirbeltieren sind 28 verschiedene Kollagentypen bekannt, die alle spezielle Eigenschaften besitzen (12). Verantwortlich für die Expression bei den Menschen sind 43 Gene (13).
Die biomechanischen Eigenschaften des Kollagens werden durch die molekulare Struktur der einzelnen Ketten hervorgerufen, Die bestimmen in welcher Art sie sich verdrillen und wie die drei-dimensionale Struktur aussieht. Das wesentliche Gerüst bildet eine Aminosäurenkette, die mit GLY-X-Y abgekürzt wird. GLY ist die Aminosäure Glycin, X ist häufig Hydroxyprolin und Y Prolin. X und Y können aber auch andere Aminosäuren sein, die dann Stränge mit anderen mechanischen Eigenschaften bilden.
Die elastischen Eigenschaften der Haut – Elastin
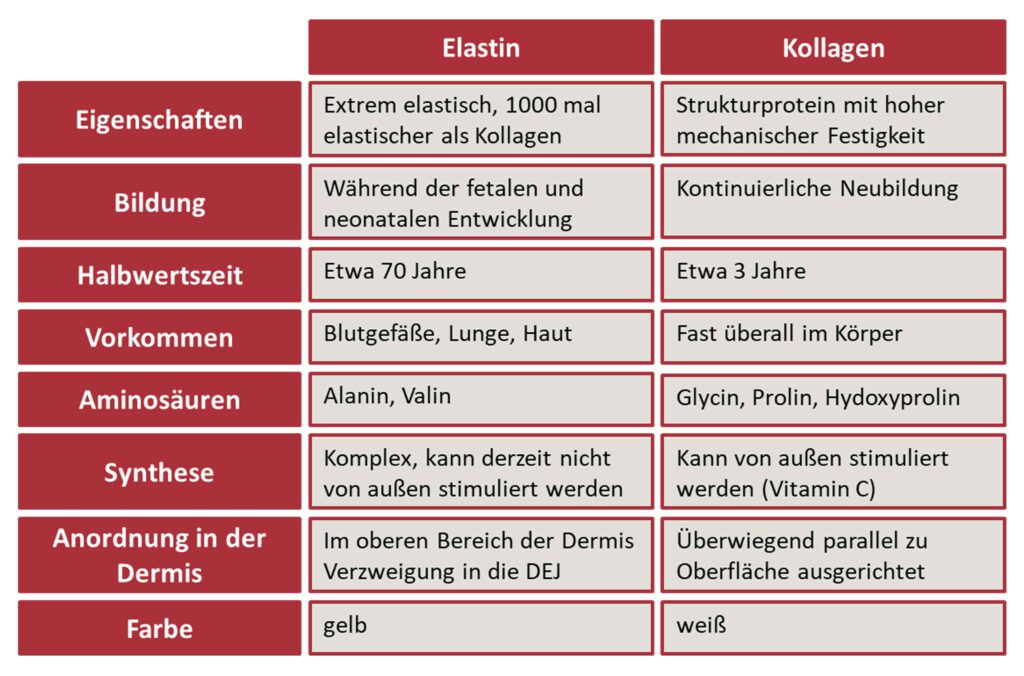
Elastin ist ein weiteres Strukturprotein der Dermis (19). Außer in der Dermis kommt es vor allem in der Lunge und in den Gefäßwänden der Aorta vor. Sein Beitrag ist die Widerstandskraft und Elastizität des Gewebes. Elastin wird überwiegend in der fötalen und neonatalen Entwicklungsphase gebildet. Im Gegensatz zu Kollagen wird es nur sehr wenig nachgebildet, hat dafür aber eine viel längere Lebensdauer. Diese längere Lebensdauer und die fehlende Neubildung führen aber auch dazu, dass Abnutzungserscheinungen nicht eliminiert oder die Moleküle ausgetauscht werden können (20-22).
Durch die mechanische Beanspruchung und Abnutzung verändern sich die biomechanischen Eigenschaften der verschiedenen Hautschichten. Besonders der Abbau des Elastins durch Proteasen verringert die Biegefähigkeit der Haut. Die Hautschichten können nicht mehr miteinander gleiten und müssen sich falten (24). Weiterhin entstehen durch den Abbau von Elastin Bruchstücke, die Entzündungen, Proliferation oder Angiogenese stimulieren.
Fibroblasten – Synthesekraftwerke der ECM
Fibroblasten sind die Zellen der Dermis. Sie kommen, anders als die epidermalen Keratinozyten, nicht im Zellverbund vor. Als Synthesekraftwerke erfüllen sie im Körper sie viele wichtige Funktionen, allen voran die Wundheilung (25, 26). Und in entzündlichen Geschehen der Haut (27).
In der Dermis produzieren und organisieren sie die ECM. Das sind außer Kollagen und Elastin auch Proteoglycane und Proteasen (28, 29).
L’Oréal hat sich vor mehr als 10 Jahren die Rolle der Fibroblasten dabei angesehen. Sie sind ebenfalls einem Alterungsprozeß unterworfen (30).
- Veränderte Morphologie und Metabolismus, verringertes proliferatives Potential
- Verlußt der Empfindlichkeit auf Wachstumsfaktoren
- Verringerte Produktion von ECM Komponenten (Kollagen I und III)
- Überproduktion von Proteasen, die diese abbauen (Matrix Metalloproteinasen MMP)
Proteoglycane – mehr als ein Gelpolster
Proteoglycane sind die Gelbildner der Dermis. Dabei ist ein Protein an eine oder mehrere Glycosaminoglycane (GAG) gekoppelt. GAGs kommen auch ungebunden in der ECM vor. Sie sind ein integraler Bestandteil der ECM, regeln den Wassergehalt, die osmotische Balance und erfüllen wichtige immunologische Aufgaben. Wichtigste Komponente ist die Hyaluronsäure (31), die in der Dermis eine essentielle Rolle in der Wundheilung spielt. Sie ist bekannt als kosmetischer Inhaltsstoff und wird seit einigen Jahren verstärkt eingesetzt. Die Hyaluronsäure der Dermis hat jedoch ein Molekulargewicht von mehr als 500 kDalton, wirkt antientzündlich, fördert die Expression von Kollagen III und Wachstumsfaktoren (32). Der Behauptung, Hyaluronsäure könnte, wenn sie nur niedermolekular wäre, in die Haut penetrieren, widersprechen aber Experten (33).
Im Zuge der Hautalterung aber werden auch die Proteoglycane zu kleineren Fragmenten abgebaut und haben dann ein komplett anderes Wirkprofil (34).
Basalmembran – die dermale – epidermale Verbindung
Die Basalmembran ist die Schicht, die die Basalschicht der Epidermis mit der Dermis verbindet. Im Englischen wird sie „basement membrane“ genannt und im Fachjargon auch „demal-epidermal-junction“ (DEJ). Die Strukturproteine, die ihre Festigkeit verursachen und gleichzeitig eine gewisse Flexibilität erlauben, werden seit einigen Jahren intensiv untersucht. Denn die Basalmembran spielt nicht nur bei der Hautalterung eine große Rolle, sondern auch bei gewissen Erkrankungen wie epidermolysis bullosa (35), oder Pemphigoid (36) und der Narbenbildung (37). Die epidermale Basalschicht, die in junger Haut stark gewellt ist (und damit eine große Oberfläche hat) und dadurch eine gute Verbindung mit der Dermis aufbaut, flacht sich mit dem Alter ab. Die Verzahnung nimmt ab und damit auch die Güte der Verbindung. Dafür sind nicht nur strukturelle Veränderungen in dieser Membran selbst verantwortlich, sondern in der Dermis insgesamt (38).
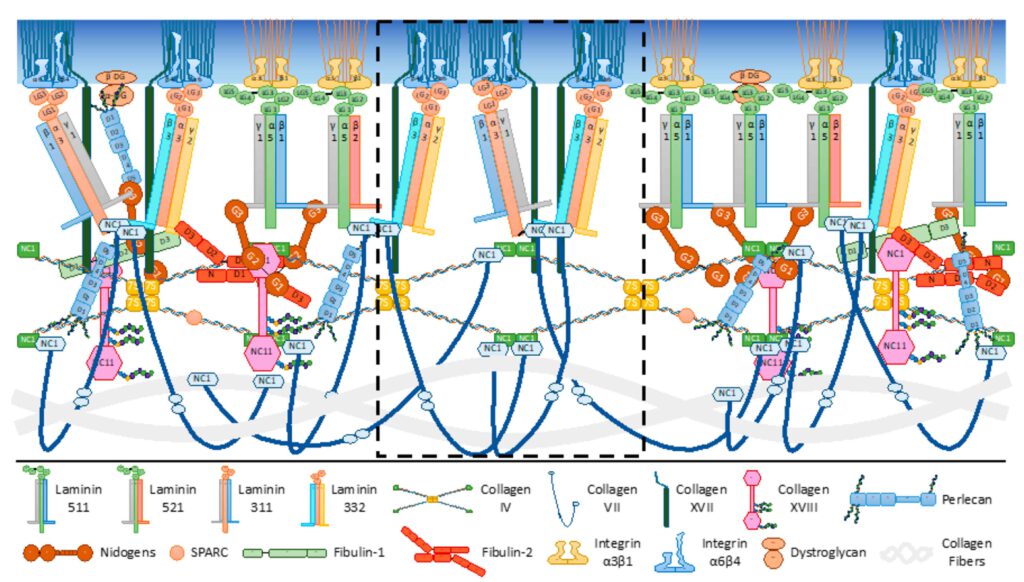
Kollagen VII ist ein typisches Verankerungsprotein, das die in der Dermis vorkommenden Kollagen I und III Fibrillen untereinander und mit den Ankerplaques aus Kollagen IV verbindet. Es entsteht ein Netzwerk mit hoher mechanischer Festigkeit. Außer Kollagenen sind Lamininen, Integrine und Nidogene wichtige Bausteine in diesem Netzwerk.
In alter Haut kommt Kollagen IV verringert vor. Untersuchungen an gealterten Fibroblasten in vitro zeigen aber, dass sich die Kollagen IV Synthese mit TGF 1ß in einer Dosis abhängigen Weise „hoch fahren“ läßt (40).
Hautalterung eine Frage der Ethnie?
Altert dunkle Haut langsamer als helle (41, 42) Zumindest zeigen einige Untersuchungen (43, 44) dass altersbedingte Falten bei den untersuchten hellhäutigen Französinnen 10 Jahre früher als bei ihren chinesischen Altersgenossinnen auftraten. Das deckt sich mit der Beobachtung, dass hellhäutigen WesteuropäerInnen eher Falten ausbilden als andere Ethnien (45). Systematische Untersuchungen dazu sind rar (41).
Im Forscherteam um Abigail Langton widmet man sich der systematischen Untersuchung des Hautalterung-Phänomens bei dunkelhäutigen. (46-48).
Aber auch hier lassen sich die bekannten Effekte der solaren Elastose – den Abbau von Elastin durch UV-Licht – beobachten. Genauso wie das extrme Abflachen der Verzahnung von Epidermis und Dermis. Zu möglichen Unterschieden bei den Reparatur- und Neubildungsmechanismen in Abhängigkeit der genetischen Herkunft gibt es bisher keine Daten. Erste orientierende Studien zu den relevanten elastischen Anteilen der ECM legen nahe, dass diese aber auch genetisch bedingt sind (49). Ebenfalls bekannt sind die Unterschiede in dem Kollagenaufbau verschiedener Ethnien (13). In wie weit diese genetischen Ursachen nun den Alterungsprozeß der Haut beeinflussen, ist noch nicht vollständig bekannt.
Therapie der Hautalterung oder Prophylaxe?
Die Liste an Anti-Aging Wirkstoffen ist lang. Der Markt ist groß und doch, die Wirksamkeit ist beschränkt. Auch wenn Trinkkollagen (50) und Anti-Falten Cremes boomen, so ist das eigentlich nur eine Behandlung der Symptome. Da das relevante Geschehen der Hautalterung in der Dermis statt findet, darf man annehmen, dass kosmetische Inhaltsstoffe dorthin nicht über die Haut gelangen. Also nur oberflächlich wirken. Auch, wenn uns die Hersteller mit tollen Versprechen und der Wirksamkeit in in vitro Tests zum Kauf überreden wollen. Eine relevante Faltenkorrektur erreicht man nur mit „drastischeren“ Mitteln, wie dem chemischen Peeling, Plasmabehandlungen, Needling oder einem chirurgischen Eingriff. Dennoch lässt sich in den komplexen Geschehen der Hautalterung nicht ein Faktor alleine „korrigieren“.
Allerdings belegen die Untersuchungen vieler ForscherInnen, dass wir die Hautalterung eher mit unserem persönlichen Lebensstil in den Griff bekommen, denn mit Kosmetik. Kurz mit Prophylaxe. Dazu gehört allerding nicht, wie manche meinen könnten, schon als Teenager Antifalten Produkte zu verwenden, sondern gewisse Risiken zu meiden. Die wesentlichen Faktoren zu frühzeitiger Hautalterung sind UV-Strahlung und Rauchen. Hilfreich sind aber schon so ganz schnöde Dinge wie eine ausgewogene Ernährung, die Millar (51) in ihrem Artikel 2018 zusammenfaßt.
Literatur
(1) Martvolumen von Anti-Aging Produkten
(2) Lemperle G. et al. A classification of facial wrinkles (2015)
(3) Gunn DA. et. al. Why some women look young for their age PLOS one (2009)
(4) Dobos, G., Lichterfeld, A., Blume-Peytavi, U. and Kottner, J. (2015), Evaluation of skin ageing: a systematic review of clinical scales. Br J Dermatol, 172: 1249-1261
(5) Addor FAS. Beyond photoaging: additional factors involved in the process of skin aging. Clin Cosmet Investig Dermatol. 2018 Sep 20;11:437-443. doi: 10.2147/CCID.S177448. PMID: 30288075; PMCID: PMC6159789.
(6) Pawlaczyk M, Lelonkiewicz M, Wieczorowski M. Age-dependent biomechanical properties of the skin. Postepy Dermatol Alergol. 2013 Oct;30(5):302-6. doi: 10.5114/pdia.2013.38359. Epub 2013 Oct 30. PMID: 24353490; PMCID: PMC3858658.
(7) DejaYu: Stratum Corneum und der washout-Effekt
(8) Walek J. Bindegewebe, Bibliothek der Anatomie (2022)
(9) Ziemer M., Histopathologie der Haut – Bindegewebekrankheiten, Springer Medizin
(10) Pfisterer K. et.al.The Extracellular Matrix in Skin Inflammation and Infection, Frontiers in Cell and Developmental Biology (2021)
(11) Naylor EC, Watson RE, Sherratt MJ. Molecular aspects of skin ageing. Maturitas. 2011 Jul;69(3):249-56. (12) Bielajew, B.J., Hu, J.C. & Athanasiou, K.A. Collagen: quantification, biomechanics and role of minor subtypes in cartilage. Nat Rev Mater 5, 730–747 (2020)
(13) Chan T-F. et. al, Natural variation in four human collagen genes across an ethnically diverse population, Genomics (2008) Vol 91 (4), 307-314
(14) Scarr G., Simple geometry in complex organisms, Journal of Bodywork and Movement Therapies (201), Vol 14(4), 424-444
(15) Wikipedia Commons: Tendon-anatomy
(16) Wikipedia: Kollagen
(17) Haq F, Ahmed N, Qasim M. Comparative genomic analysis of collagen gene diversity. 3 Biotech. 2019;9(3):83
(18) Wikipedia.org:Collagen
(19) Baumann L, Bernstein EF, Weiss AS, et al. Clinical Relevance of Elastin in the Structure and Function of Skin. Aesthet Surg J Open Forum. 2021;3(3)
(20) Kristensen JH, Karsdal MA, Chapter 30 – Elastin, Biochemistry of Collagens, Laminins and Elastin, Academic Press (2016) 197-201
(21) Van Doren SR. Matrix metalloproteinase interactions with collagen and elastin. Matrix Biol. 2015;44-46:224-231.
(22) Freitas-Rodríguez S. et al., The role of matrix metalloproteinases in aging: Tissue remodeling and beyond, Biochimica et Biophysica Acta (BBA) – Molecular Cell Research (2017),Vol. 1864, 2015-2025
(23) Sawakinome: Unterschied Kollagen und Elastin
(24) Kruglikov IL, Scherer PE. Skin aging as a mechanical phenomenon: The main weak links. Nutr Healthy Aging. 2018;4(4):291-307.
(25) Tracy LE, Minasian RA, Caterson EJ. Extracellular Matrix and Dermal Fibroblast Function in the Healing Wound. Adv Wound Care (New Rochelle). 2016;5(3):119-136.
(26) Wikipedia.org: Fibroblast
(27) Schuster, R, Rockel, JS, Kapoor, M, Hinz, B. The inflammatory speech of fibroblasts. Immunol Rev. 2021; 302: 126– 146
(28) Dellambra E, Dimri GP, Chapter 7 – Cellular Senescence and Skin Aging, In Personal Care & Cosmetic Technology, Skin Aging Handbook, William Andrew Publishing (2009), 129-148.
(29) Cole MA, Quan T, Voorhees JJ, Fisher GJ. Extracellular matrix regulation of fibroblast function: redefining our perspective on skin aging. J Cell Commun Signal. 2018;12(1):35-43.
(30) Mine S, Fortunel NO, Pageon H, Asselineau D (2008) Aging Alters Functionally Human Dermal Papillary Fibroblasts but Not Reticular Fibroblasts: A New View of Skin Morphogenesis and Aging. PLoS ONE 3(12): e4066.
(31) Lee DH, Oh JH, Chung JH. Glycosaminoglycan and proteoglycan in skin aging. J Dermatol Sci. 2016 Sep;83(3):174-81.
(32) Lauren E. Tracy, Raquel A. Minasian, and E.J. Caterson.Advances in Wound Care.Mar 2016.119-136.
(33) Dermaviduals: Hyaluronsäure
(34) Papakonstantinou E, Roth M, Karakiulakis G. Hyaluronic acid: A key molecule in skin aging. Dermatoendocrinol. 2012;4(3):253-258.
(35) Bruckner-Tuderman L, Has C, Disorders of the cutaneous basement membrane zone—The paradigm of epidermolysis bullosa, Matrix Biology (2014), Vol. 33, 29-34.
(36) Schmidt E, Zilikens D, Pemphigoid diseases, The Lancet (2013), Vol.381 ( 9863), 320-332.
(37) Yang, S., Sun, Y., Geng, Z., Ma, K., Sun, X., Fu, X.“Abnormalities in the basement membrane structure promote basal keratinocytes in the epidermis of hypertrophic scars to adopt a proliferative phenotype“. International Journal of Molecular Medicine 37, no. 5 (2016): 1263-1273.
(38) Langton AK et. al. , The impact of intrinsic ageing on the protein composition of the dermal-epidermal junction, Mechanisms of Ageing and Development (2016), Vol. 156, 14-16.
(39) Roig-Rosello E, Rousselle P. The Human Epidermal Basement Membrane: A Shaped and Cell Instructive Platform That Aging Slowly Alters. Biomolecules. 2020; 10(12):1607.
(40) Feru J, Delobbe E, Ramont L, Brassart B, Terryn C, Dupont-Deshorgue A, Garbar C, Monboisse JC, Maquart FX, Brassart-Pasco S. Aging decreases collagen IV expression in vivo in the dermo-epidermal junction and in vitro in dermal fibroblasts: possible involvement of TGF-β1. Eur J Dermatol. 2016 Aug 1;26(4):350-60.
(41) Vashi NA, de Castro Maymone MB, Kundu RV. Aging Differences in Ethnic Skin. J Clin Aesthet Dermatol. 2016;9(1):31-38.
(42) BBC: Does darker skin wrinkles less?
(43) Makrantonaki E. et al., Genetics and skin aging, Dermato-Endocrinology (2012), 280-284.
(44) Nouveau-Richard S, Yang Z, Mac-Mary S, Li L, Bastien P, Tardy I, Bouillon C, Humbert P, de Lacharrière O. Skin ageing: a comparison between Chinese and European populations. A pilot study. J Dermatol Sci. 2005 Dec;40(3):187-93.
(45) Peptan:Does ethnicity affect how skin ages?
(46) Langton AK et al. Aging in Skin of Color: Disruption to Elastic Fiber Organization Is Detrimental to Skin’s Biomechanical Function, Journal of Investigative Dermatology (2019), Vol. 113 (4), 779-788.
(47) Langton, A., Graham, H., McConnell, J., Sherratt, M., Griffiths, C. and Watson, R. (2017), Organization of the dermal matrix impacts the biomechanical properties of skin. Br J Dermatol, 177: 818-827.
(48) Langton AK, Alessi S, Hann M, Chien AL, Kang S, Griffiths CEM, Watson REB. Aging in Skin of Color: Disruption to Elastic Fiber Organization Is Detrimental to Skin’s Biomechanical Function. J Invest Dermatol. 2019 Apr;139(4):779-788.
(49) Langton, AK, Hann, M, Costello, P, et al. Heterogeneity of fibrillin-rich microfibrils extracted from human skin of diverse ethnicity. J Anat. 2020; 237: 478– 486.
(50) Pinkmelon: Trinkkollagen
(51) Millar SE, Revitalizing Aging Skin through Diet, Cell (2018), Vol. 175 (6) 1461-1463.
Bildnachweis
Titelbild Shutterstock 181194065 https://www.shutterstock.com/de/image-illustration/computer-generated-abstract-background-detail-white-181194065 , Autor https://www.shutterstock.com/de/g/mrdoggs,
Alle Tabellen, eigene Werke verwendbar unter der Creative Commons Lizenz CC BY-SA 3.0
Abbildung 1 und 3, eigene Werke verwendbar unter der Creative Commons Lizenz CC BY-SA 3.0
Abbildung 2: https://pubmed.ncbi.nlm.nih.gov/21612880/
Abbildung 4: https://www.mdpi.com/2218-273X/10/12/1607/htm
Abbildung 5: https://pubmed.ncbi.nlm.nih.gov/30404021/